尽管医学进展日新月异,但全球仍有95%的罕见疾病(rare diseases)仍处于无药可医的状态。为了照顾罕见疾病患者的需求,除了聚焦特定遗传性罕见疾病开发药物的生技公司,也有国际大型药厂聚焦特定罕见疾病。「孤儿药」指的是用来治疗、预防或诊断罕见疾病的药品。由于这些疾病影响的人口很少,每一种疾病可能只有几千人或更少,因此市场回报有限,制药公司通常缺乏开发动机。为了解决这个问题,政府透过「孤儿药认定」(Orphan Drug Designation,ODD)给予开发这些药物的诱因。

孤儿药认定是由政府机关所提供的特殊法规制度,旨在鼓励制药公司研发治疗罕见疾病的药物。以美国为例,药品若要获得孤儿药认定,必须符合疾病影响美国少于20万人;或是虽然患者超过20 万人,但药物无法在没有政府补助的情况下收回研发成本。台湾地区生物技术开发中心企划管考室主任寇怡衡指出,孤儿药指的是所有适应症均为罕病的药品,或适应症包括罕病及一般适应症、但罕病适应症的销售额必须高于总销售额50%。一旦药物获得孤儿药认定,可能适用于快速审查或优先审查,并可申请政府研究补助,成功开发药物后,可享有7年市场专属权,即使专利期已过,美国食品药品监督管理局(FDA)也不会批准其他相同适应症的药物;此外,临床试验成本可获得高达25%的税收减免。1983年美国《孤儿药法案》促进全球孤儿药的发展,至2025年5月底,FDA共授予7,385项孤儿药认定,其中1,323项获得上市许可,而近5年核准上市新药,超过半数具孤儿药认定资格。
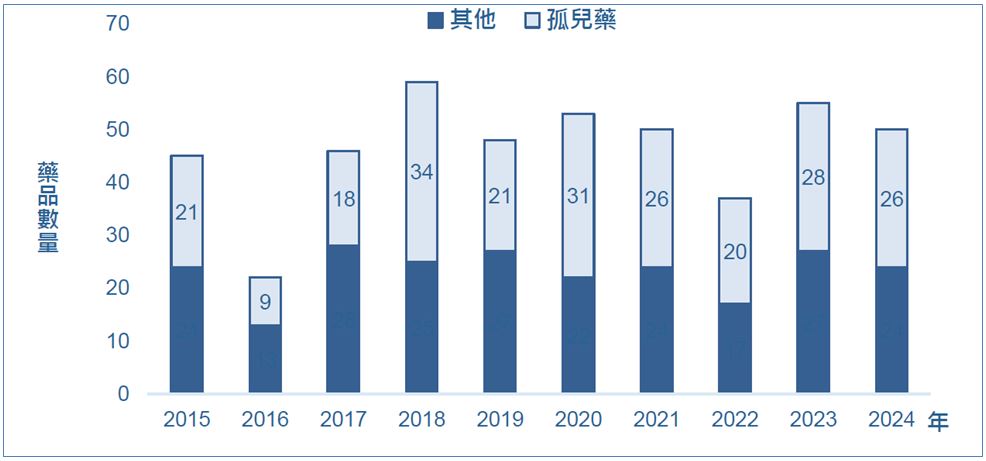
不过,罕见疾病仍具有未满足医疗需求,根据美国罕见疾病组织(National Organization for Rare Disease, NORD)统计,目前已有超过11,000种罕见疾病,目前约有4%~6%罕见疾病已有至少1种孤儿药可以治疗,亦即仍有95%的罕见疾病仍处于无药可医的状态。
药厂切入孤儿药开发之策略
为了照顾罕见疾病患者的需求,有些生技公司会聚焦特定遗传性罕见疾病,开发治疗药物;也有大型药厂聚焦特定罕见疾病。寇怡衡举例,美国药厂Vertex专注研究囊性纤维化(CF)、大型医疗保健制造商Johnson & Johnson则以多发性骨髓瘤(MM)为公司重点发展领域,两家公司所开发的孤儿药都进入全球孤儿药销售前十名。
以孤儿药认定加速药品上市
囊性纤维化是一种罕见的、缩短寿命的遗传性疾病,目前约有10.9万人患有囊性纤维化,美国、欧洲、澳洲和加拿大占全球囊性纤维化人口的绝大多数。随着囊性纤维化跨膜传导调节器(CFTR)调节疗法的出现,得以解决疾病的根本原因,让CF的治疗发生了巨大变化。
Vertex是一家总部位于美国波士顿的制药公司,致力于设计、开发治疗CF的药物,至今已获许可的的五种药物,适用于约90%的CF患者,有超过 75,000名患者正在接受Vertex药品的治疗。除美国以外,Vertex的CF药物已销往六大洲的60多个国家。未来Vertex将为那些因疾病特殊性而无法从现有的CF药物中受益的剩余患者,继续提供先进的治疗方法[1]。寇怡衡指出,Vertex聚焦研发治疗严重疾病的小分子药物,预测2028年孤儿药占Vertex整体药品销售额高达94%。
除了聚焦于特定罕病精进药物开发,更多数的大型药厂是先以罕病加速药物上市,再扩展至市场较大的适应症,例如美国默克药厂(Merck)开发的免疫疗法抗癌药品Keytruda,已经被FDA批准用于多种癌症的治疗,但2014年是以黑色素瘤首次获上市许可。寇怡衡进一步解释,孤儿药认定的主要价值,在于上市后可获得市场专属权的保障(但仅限于获上市许可的适应症),对于药厂而言,可利用同一孤儿药认定下的适应症或扩展应用,以延续市场的专属权保障。
RMAT认定加速上市
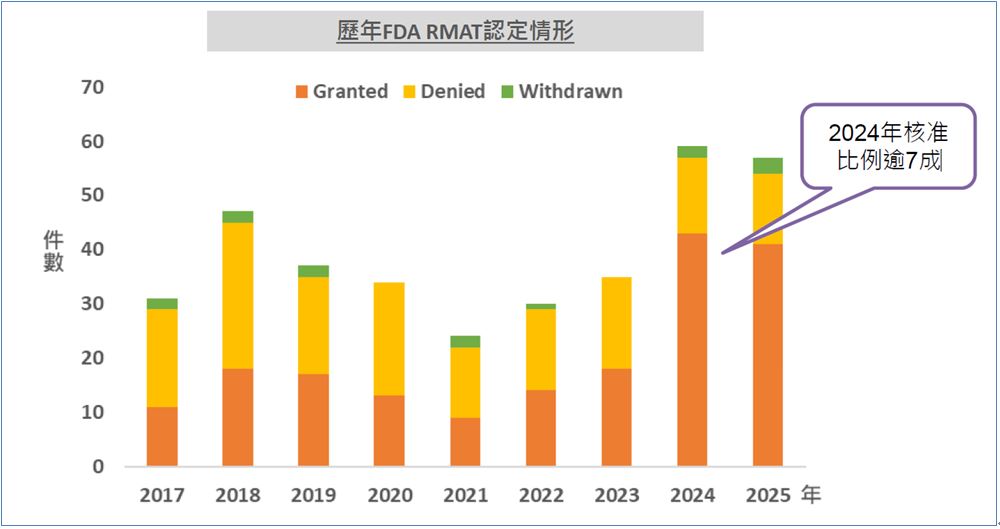
2016年12月FDA增加「再生医疗先进疗法认定」(Regenerative Medicine Advanced Therapy Designation,RMAT),让治疗严重疾病的再生医学疗法能加速上市。RMAT是一种美国FDA为新型再生医疗产品设立的加速审查资格,但仅限于再生医疗产品,包括细胞疗法、治疗性组织工程产品、人体细胞和组织产品、或组合产品。获得RMAT认定后,FDA 将主动协助产品开发策略、临床试验设计,并获得加速上市审查机会,缩短开发与审查时间。
与美国 FDA「快速审查」(Fast Track)认定、突破性疗法(Breakthrough Therapy)等其他加速通道相比,RMAT认定的强度更强,但仅限再生医疗产品。寇怡衡指出,RMAT申请案逐年成长,至2024年底累积申请297案,通过143案,FDA核准比例逾七成;2025年至6月底已有71案申请、通过41案,目前为止并无RMAT通过后撤回或撤销的案件。
藉由「认定」(Designation)加速产品开发进程
美国FDA于今年6月宣布一项新的国家优先凭证计划(Commissioner’s National Priority Voucher,CNPV),提供机会给限量的药物和生物制剂开发商参与。FDA预计在CNPV计划实施的第一年,向符合美国国家重点的公司提供有限数量的审批,符合美国国家优先事项进行研发的厂商,可获得加强沟通和滚动审查等特殊福利;如果使用审批的产品符合加速审批的法律要求,FDA可能会授予加速审批,让审查药物和生物制剂的审批时间,从10~12个月缩短至1~2个月[2],这项CNPV先导计划已于2025年7月22日开始实施。
寇怡衡认为,善用「认定」可加速新药产品开发进程,新药厂商应随时更新各项认定及规范信息,让认定成为产品开发重要的助力。
数据源:
- 2025/7/24,台湾地区资策会科技法律研究所主办「创新药品加速上市法制与产业策略报告发布会」,寇怡衡简报
备注:
[1] 参考数据:Vertex: CF facts and figures.
[2] 参考数据:FDA: Commissioner’s National Priority Voucher (CNPV) Pilot Program.
|